Di seguito riportiamo un commento pubblico fatto da Barbara Loe Fisher, Cofondatrice e Presidente dell’NVIC, il 13 novembre scorso, al convegno del VRBPAC (Comitato consultivo dei vaccini e prodotti biologici correlati dell’FDA) sulla proposta di modifiche ai requisiti previsti dall’FDA per l’approvazione dei vaccini destinati all’uso in gravidanza.
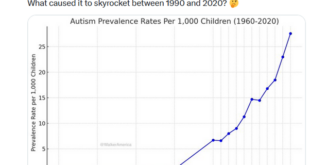
Sono malformazioni congenite, danni cromosomici, parti prematuri, basso peso alla nascita, complicazioni in gravidanza e SIDS, anziché qualche malattia infettiva, le principali cause di morte dei circa 23.000 bambini che ogni anno, negli Stati Uniti, non arrivano al loro primo compleanno e, nella metà dei casi, neppure al secondo giorno di vita (1 , 2). Le gestanti e le neomamme americane, oggi, corrono un rischio più di due volte maggiore di morire durante la gravidanza, durante il parto o entro un anno da quest’ultimo rispetto a trent’anni fa. Tra le principali cause: insufficienza cardiaca, ipertensione e infarto, diabete e coaguli sanguigni (3 , 4).
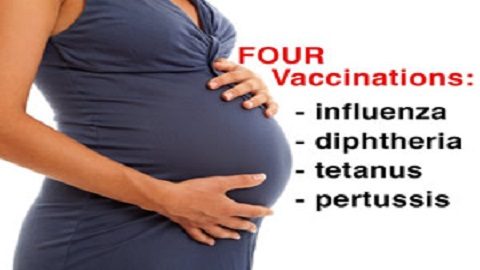
Nel 2006, i funzionari del CDC suggerivano ai medici di somministrare a tutte le gestanti il vaccino antinfluenzale (5) e, nel 2011, una dose di TDaP ad ogni gravidanza, indipendentemente dall’intervallo trascorso rispetto alla precedente (6). Prima dell’approvazione dell’FDA, i vaccini contro influenza, difterite, tetano e pertosse non sono stati testati né si sono dimostrati sicuri ed efficaci per le gestanti coinvolte negli studi clinici su larga scala quando somministrati ad ogni gestazione, sia singolarmente che congiuntamente (7 , 8).
L’FDA li classifica come prodotti biologici di categoria B e C per la gravidanza (9) in quanto non se ne conoscono la genotossicità e la potenziale capacità di causare danni al feto o influire su fertilità e concepimento futuri delle donne. La somministrazione dei vaccini antinfluenzale e TDaP alle donne in gravidanza rappresenta un uso che va al di fuori (off-label) delle previste indicazioni (10 , 11 , 12). Ed è una pratica che guarda alla vaccinazione materna come necessaria, sicura ed efficace senza aver dimostrato che effettivamente lo sia (13).
Il vaccino TDaP è stato approvato dall’FDA come richiamo singolo per la pertosse in soggetti di età superiore ai 10-11 anni, ma danni e decessi da vaccino antipertosse sono al primo posto nelle cause di indennizzo erogato dal programma nazionale di risarcimento dei danni da vaccino (VICP) per bambini e neonati, mentre danni e decessi da antinfluenzale sono al primo posto nelle cause risarcite agli adulti (14). Tuttavia, pur mancando prove credibili basate sui meccanismi biologici e sui dati epidemiologici capaci di dimostrare, prima della loro approvazione, che tali vaccini siano sicuri per tutte le gestanti, insieme ai loro feti e neonati, le dipendenti dei reparti di ostetricia e ginecologia che li rifiutano in gravidanza vanno incontro al licenziamento (15).
Questa politica di vaccinazione in gravidanza costituisce una violazione del principio di precauzione “Primo, non nuocere” (16) ed è motivo di grave preoccupazione per le future mamme americane, specie le gestanti del comparto socio-sanitario. Quando le raccomandazioni federali per l’utilizzo dei vaccini vengono convertite in leggi che puniscono chi si rifiuta di ubbidire con la negazione del diritto all’istruzione scolastica, alle cure mediche e all’occupazione (17 , 18) , garantire standard elevati per l’approvazione dei vaccini da parte dell’FDA è assolutamente essenziale.
Non esistono studi prospettivi mirati a lungo termine che esaminino ampi gruppi di donne americane vaccinate in gravidanza con antinfluenzale e TDaP e confrontino il loro stato di salute e le condizioni dei loro feti e neonati rispetto a quelli di donne non vaccinate. Non esistono studi pubblicati che permettano di identificare le infiammazioni da vaccino irrisolte nel cervello e nel corpo del feto, della madre e del neonato o che permettano di misurare le variazioni atipiche del cervello, della funzione immunitaria e dell’integrità cromosomica, nonché il numero delle mutazioni ex-novo già presenti prima o intervenute dopo la vaccinazione.
La pratica della vaccinazione materna è storicamente precedente alla scienza della sicurezza vaccinale. Ora, viene sottoposta al vaglio di questo Comitato e nell’ambito del 21st Century Cures Act la proposta, appoggiata dall’FDA e dall’industria farmaceutica, di abbassare gli standard FDA per l’approvazione dei vaccini al fine di assicurare che la pratica vaccinatoria continui a precedere, anche in futuro, la sicurezza stessa dei vaccini (19). Il lungo dibattito di oggi circa la possibilità di supporre a priori che le complicazioni e la morte in età fetale in seguito a vaccinazione materna siano solo coincidenze non legate da nesso causale alla vaccinazione (20) è un forte segnale d’allarme per tutti coloro che si sottopongono abitualmente a profilassi vaccinale, in assenza di prove patologiche attendibili capaci di stabilire in via definitiva cosa è indotto dai vaccini e cosa non lo è.
L’NVIC si oppone alla possibilità che l’FDA approvi retroattivamente i vaccini antinfluenzale e TDaP per l’uso in gravidanza e acceleri l’approvazione dei vaccini per VRS (Virus Respiratorio Sinciziale) (21) e streptococco di gruppo B (22) utilizzando studi clinici di portata ridotta; studi adattativi; metodi bayesiani di analisi dei dati; biomarcatori ed endpoint surrogati piuttosto che dati clinici reali; o utilizzando esperienza clinica invece di scienza applicata in laboratorio e studi clinici retrospettivi con successivi controlli a lungo termine per dimostrarne efficacia e sicurezza.
Il fatto che chi produce, regolamenta, fornisce vaccini e ne disciplina l’uso è completamente al riparo da ogni responsabilità civile in caso di danno o decesso da vaccino (23) rende ancora più importante che gli standard FDA per la dimostrazione di sicurezza ed efficacia dei vaccini siano elevatissimi, con un riguardo particolare verso i vaccini destinati alle gestanti e ai loro piccoli non ancora nati.
Traduzione di Angelica Perrini e Luana DiEmme
Riferimenti
1 Mathews TJ, MacDorman MF, Thoma ME. Infant Mortality Statistics From the 2013 Period Linked Birth/InfantDeath Data Set . National Vital Statistics Reports 2015; 64(9).
2 Manning A. U.S. Top of List for First-Day Deaths in Rich Nations: More Babies Die on Their First Day of Life in the United States Than In Any Other Industrialized Country. National Geographic News May 8, 2013.
3 CDC. Pregnancy Mortality Surveillance System. Trends in Pregnancy-Related Deaths . Sept. 16, 2015.
4 Munz M. Why Are So Many US Women Dying During Childbirth? St. Louis Post Dispatch April 7, 2013.
5 Centers for Disease Control (CDC). Prevention and Control of Influenza. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR July 28, 2006; 55(RR10): 1-42.
6 CDC. Updated Recommendations for Use of Tetanus Toxoid, Reduced Diphtheria Toxoid and Acellular Pertussis (Tdap) in Pregnant Women and Persons Who Have or Anticipate Having Close Contact with an Infant Aged Under 12 Months – ACIP, 2011. MMWR 2011; 60(41): 1424-1426.
7 Gruber MF. Maternal Immunization: US FDA Regulatory Considerations . Vaccine 2003; 21(24): 3487-3491.
8 Fisher BL, Wrangham TK. Public Comment to National Vaccine Advisory Committee (NVAC) Maternal Immunization Working Group (MIWG) on MIWG Recommendations on Maternal Immunization . Apr. 25, 2014.
9 Drugs.com. FDA Pregnancy Categories. October 2013.
10 NVIC.org . Influenza Vaccine Package Inserts (2015-2016): Important Information from Manufacturers . NVIC 2013.
11 Sanofi Pasteur. Adacel (Tetanus Toxoid, Reduced Diphtheria Toxoid and Acellular Pertussis Vaccine, Adsorbed) Full Prescribing Information . Use in Specific Populations: 8.1 Pregnancy Category C. Sanofi Pasteur April 2013.
12 Glaxo-Smith Kline. BOOSTRIX (Tetanus Toxoid, Reducated Diphtheria Toxoid and Acellular Pertussis Vaccine, Adsorbed) Full Prescribing Information . Specific Populations: 8.1 Pregnancy Category B.
13 Fisher BL. Vaccination During Pregnancy: Is It Safe? NVIC Newsletter Nov. 9, 2013.
14 Health Resources Services Administration (HRSA). Vaccine Injury Compensation Program Data & Statistics.
15 CBS News. Pregnant nurse fired for refusing flu shot. Dec. 28, 2013.
16 Science & Environmental Health Network (SEHN). The Wingspread Statement on the Precautionary Principle. SEHN January 1998.
17 Fisher BL.Women, Vaccines & Bodily Integrity. NVIC Newsletter Jan. 24, 2013.
18 Richardson D. The Fallout from California SB277 – What Happens Next? NVIC Newsletter Aug. 5, 2015.
19 Fisher BL. Here Comes the 21st Century Cures Act: Say Goodbye to Vaccine Safety Science . NVIC Newsletter July 21, 2015.
20 FDA. Nov. 13, 2015 VRBPAC Meeting Agenda and FDA Briefing Document: Clinical Development and Requirements for Licensure of Vaccines Intended for Use During Pregnancy to Prevent Disease in the Infant .
21 Fierce Vaccines. Novavax (Nvax) Receives FDA Fast-Track Designation for RSV F Vaccine Candidate . Dec. 4, 2014.
22 Edwards MS, Gonik B. Preventing the broad spectrum of perinatal morbidity and mortality through group B streptococcal vaccination . Vaccine 2013; 31 (Supple 4).
23 Fisher BL. Vaccine Injury Compensation: Government’s Broken Social Contract with Parents. NVIC Newsletter Nov. 2, 2015.
 quival.it tutto quello che avresti voluto sapere ma non hai mai osato chiedere
quival.it tutto quello che avresti voluto sapere ma non hai mai osato chiedere